آشنایی با مقررات تجهیزات پزشکی اتحادیه اروپا و ISO 13485
همانطور که چشم انداز صنعت تجهیزات پزشکی در حال تکامل است، شناخت و درک تفاوت های ظریف استانداردهای نظارتی و سیستم های مدیریتی در آینده به طور فزاینده ای ضروری است.
هر دو مقررات تجهیزات پزشکی اتحادیه اروپا (EU MDR) و ISO 13485 نقش مهمی در تضمین ایمنی، کیفیت و اثربخشی تجهیزات پزشکی دارند.
مقررات تجهیزات پزشکی اتحادیه اروپا یا EU MDR چیست؟
MDR اتحادیه اروپا مقرراتی است که بر تولید، بازاریابی و توزیع تجهیزات پزشکی در اتحادیه اروپا (EU) حاکم است. مقررات تجهیزات پزشکی اتحادیه اروپا در سال 2017 تصویب شد و جایگزین دستورالعمل قبلی تجهیزات پزشکی (MDD) شد. در 26 مه 2021 به طور کامل قابل اجرا شد.
هدف اصلی مقررات تجهیزات پزشکی اتحادیه اروپا تضمین ایمنی و عملکرد دستگاههای پزشکی و در عین حال افزایش ایمنی بیمار و کاربر است. مقررات تجهیزات پزشکی اتحادیه اروپا مقررات و الزامات سختگیرانهتری را برای تولیدکنندگان، واردکنندگان، توزیعکنندگان و سایر ذینفعان درگیر در زنجیره تامین معرفی میکند. این مقررات در مورد طیف وسیعی از وسایل پزشکی از جمله ایمپلنت ها، تجهیزات تشخیصی، ابزار جراحی و نرم افزارهای مورد استفاده برای مقاصد پزشکی اعمال می شود.
ویژگی های مهم مقررات تجهیزات پزشکی اتحادیه اروپا عبارتند از:
- دامنه گسترده – این مقررات تعریف تجهیزات پزشکی را به گونهای گسترش میدهد که محصولاتی را که قبلاً تنظیم نشده بودند، مانند دستگاههای زیبایی شناختی خاص و محصولات تمیزکننده، شامل شود.
- طبقه بندی مبتنی بر خطر – دستگاه های پزشکی اکنون بر اساس خطرات احتمالی خود به چهار دسته طبقه بندی می شوند:
- کلاس I – وسایل پزشکی کم خطر
- کلاس IIa – دستگاه های پزشکی کم خطر تا متوسط
- کلاس IIb – وسایل پزشکی با خطر متوسط تا بالا
- کلاس III – دستگاه های پزشکی پرخطر
- الزامات شواهد بالینی دقیق تر – مقررات تجهیزات پزشکی اتحادیه اروپا بر نیاز به داده های بالینی جامع، از جمله ارزیابی ها و پیگیری های پس از فروش، برای نشان دادن ایمنی و عملکرد دستگاه تأکید می کند.
- شناسایی منحصر به فرد دستگاه (UDI) – یک سیستم UDI الزامی است که امکان ردیابی و نظارت بهتر دستگاه ها را در طول چرخه عمر آنها فراهم می کند.
- تقویت نظارت پس از فروش – سیستمهای نظارتی قوی برای نظارت فعال بر عملکرد دستگاه و گزارش حوادث به مقامات لازم است.
- نهادهای اطلاعرسانی شده و رویههای بررسی – سازمانهای اعلامشده با الزامات و بررسی دقیقتر برای اطمینان از صلاحیت و استقلال در ارزیابی و تأیید دستگاهها مواجه هستند.
- افزایش شفافیت و دسترسی – ایجاد EUDAMED امکان دسترسی عمومی به اطلاعات دستگاه، از جمله دادهها و گواهیهای UDI را فراهم میکند.
- همکاری بین کشورهای عضو – مقررات تجهیزات پزشکی اتحادیه اروپا همکاری بین کشورهای عضو را برای یک رویکرد هماهنگ برای مقررات تجهیزات پزشکی و دسترسی به بازار تقویت می کند.
هدف این ویژگی های کلیدی مقررات تجهیزات پزشکی اتحادیه اروپا تقویت ایمنی بیمار، بهبود کیفیت و قابلیت اطمینان دستگاه های پزشکی و افزایش شفافیت و نظارت در سراسر چرخه عمر دستگاه های پزشکی در اتحادیه اروپا است.
ISO 13485 چیست؟
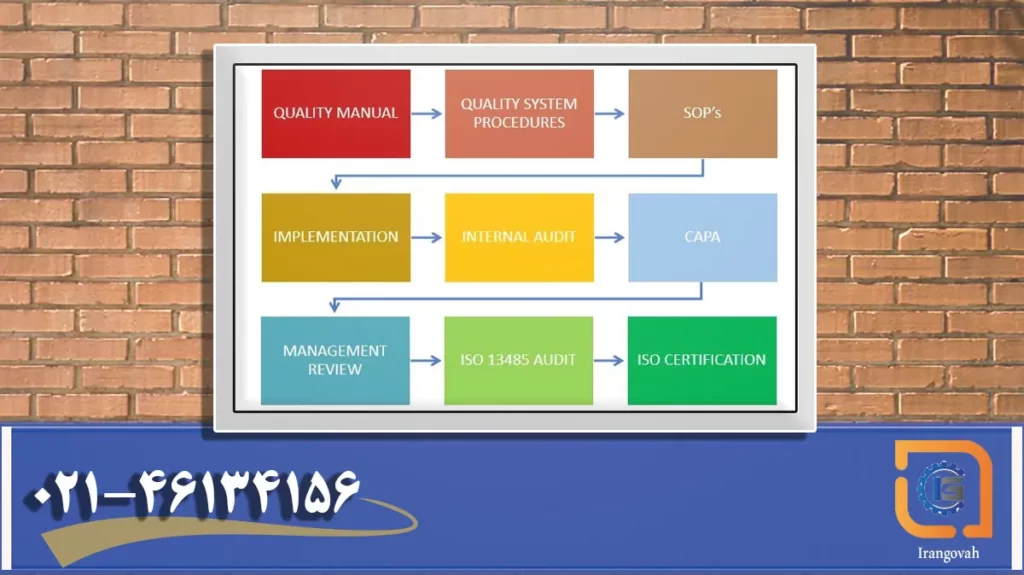
ISO 13485 یک استاندارد بین المللی برای سیستم های مدیریت کیفیت است که به طور خاص برای صنعت تجهیزات پزشکی طراحی شده است. این الزامات را برای یک سازمان درگیر در طراحی، توسعه، تولید، نصب و خدمات تجهیزات پزشکی فراهم می کند.
جنبه های کلیدی ISO 13485 عبارتند از:
- سیستم مدیریت کیفیت (QMS) – ISO 13485 الزامات را برای ایجاد و حفظ یک QMS قوی برای برآورده کردن مستمر الزامات مشتری و نظارتی، رسیدگی به خطرات، و اطمینان از ایمنی دستگاه و عملکرد خوب، تشریح میکند.
- مسئولیت مدیریت – در ISO 13485، رهبری مدیریت ارشد به شدت در ایجاد و حفظ سیستم مدیریت کیفیت و مدیریت منابع نقش دارد.
- مدیریت منابع – ISO 13485 نیازمند اطمینان از در دسترس بودن، شایستگی و تخصیص مناسب منابع لازم است.
- تحقق محصول – تحقق محصول در ISO 13485 شامل فرآیندهایی از طراحی و توسعه تا تولید، تأیید، اعتبار سنجی و تحویل دستگاههای پزشکی میشود و اطمینان حاصل میکند که آنها الزامات نظارتی و مشتری را برآورده میکنند.
- اندازه گیری، تجزیه و تحلیل و بهبود – ISO 13485 جمع آوری داده ها، تجزیه و تحلیل برای ارزیابی عملکرد، شناسایی فرصت های بهبود و اجرای اقدامات پیشگیرانه را پوشش می دهد که همه با هدف افزایش اثربخشی سیستم مدیریت کیفیت انجام می شود.
رابطه بین ISO 13485 و مقررات تجهیزات پزشکی اتحادیه اروپا چیست؟
اگرچه مرتبط هستند، اما ISO 13485 و EU MDR دو چارچوب متفاوت هستند که هنگام بررسی ارزیابی انطباق، می توان ارتباط آنها را به بهترین نحو درک کرد.
توجه به این نکته حائز اهمیت است که اگرچه گواهینامه ISO 13485 یک الزام قانونی برای تولیدکنندگان تجهیزات پزشکی برای عرضه محصولات خود در بازار اروپا نیست، اما می تواند انطباق با MDR اتحادیه اروپا و نه تنها را تا حد زیادی تسهیل کند. ISO 13485 همچنین مزایای زیادی از جمله بهبود مدیریت کیفیت، مدیریت ریسک، بهبود مستمر، مزیت های رقابتی و غیره را ارائه می دهد. تولیدکنندگان همچنان ملزم به رعایت الزامات نظارتی مشخص شده در مقررات تجهیزات پزشکی اتحادیه اروپا هستند و یک QMS منطبق بر ISO 13485 را پیاده سازی می کنند.
ISO 13485 به سازندگان تجهیزات پزشکی کمک می کند تا از MDR اتحادیه اروپا پیروی کنند:
- ISO 13485 از طراحی گرفته تا نظارت پس از فروش، روشی سیستماتیک برای کنترل خطرات مرتبط با تجهیزات پزشکی در تمام طول عمر آنها ارائه می دهد و به اطمینان از کارایی و ایمنی آنها کمک می کند.
- ISO 13485 با تعیین معیارهایی برای ارزیابی و انتخاب تامین کنندگان و پیمانکاران فرعی و همچنین نظارت بر عملکرد آنها به اطمینان از کیفیت و قابلیت ردیابی مواد و اجزای مورد استفاده در تجهیزات پزشکی کمک می کند.
- ISO 13485 با تعریف الزامات اسناد و سوابق، مانند پروندههای فنی، گزارشهای ارزیابی بالینی، و برنامههای نظارت پس از عرضه به بازار، به سازمانها و مقامات آگاه در نشان دادن انطباق با MDR اتحادیه اروپا و تسهیل ممیزی و بازرسی کمک میکند.
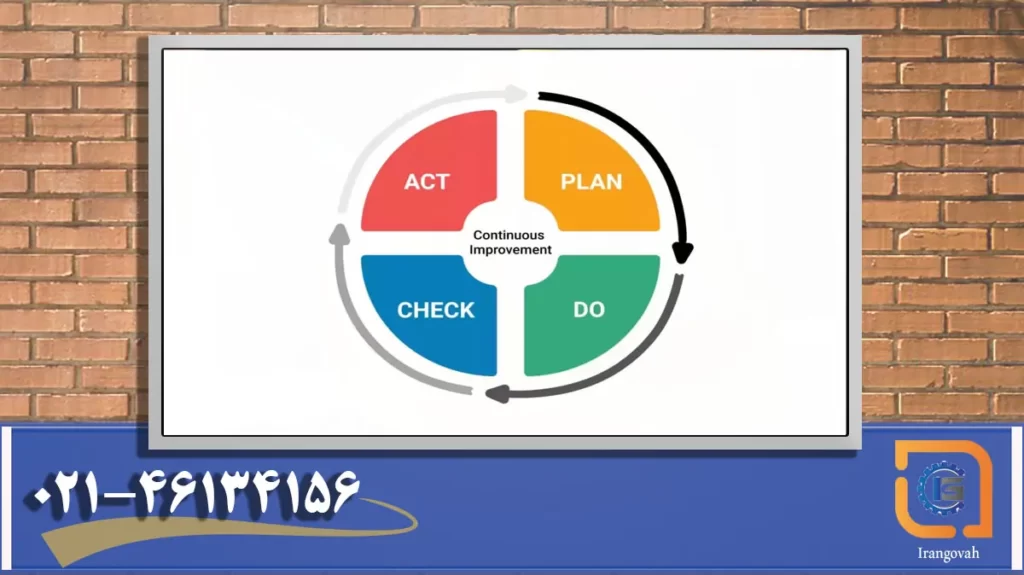
- ISO 13485 از اجرای فرهنگ بهبود مستمر با نیاز به بازبینی و ممیزی منظم QMS و همچنین اقدامات اصلاحی و پیشگیرانه پشتیبانی می کند. این به افزایش کیفیت و عملکرد دستگاههای پزشکی و انطباق با نیازهای متغیر مشتری و نظارتی کمک میکند.
ISO 13485 که ابزاری ارزشمند برای سازندگان تجهیزات پزشکی است، پایه ای قوی برای پیروی از مقررات تجهیزات پزشکی اتحادیه اروپا فراهم می کند. علاوه بر این، سازمان ها می توانند با اجرای فرآیندها و رویه های اضافی مورد نیاز، کاملاً با الزامات MDR اتحادیه اروپا هماهنگ شوند.