آیا FDA با استاندارد ISO 13485:2016 منطبق می شود؟
FDA یک مقررات پیشنهادی را منتشر کرد و درخواست نظر عمومی را برای اصلاح الزامات عملکرد تولید خوب فعلی دستگاه مربوط به مقررات سیستم کیفیت (QS) منتشر کرد تا استاندارد بینالمللی ویژه سیستم های مدیریت کیفیت دستگاه های پزشکی را که توسط سازمان بین المللی تنظیم شده است در بر گیرد.

در حالی که مقررات QS فعلی الزامات کافی و موثر را برای استقرار و نگهداری یک سیستم مدیریت کیفیت فراهم می کند، انتظارات نظارتی برای یک سیستم مدیریت کیفیت از زمانی که این مقررات بیش از 20 سال پیش اجرا شد، تکامل یافته است. FDA به دنبال هماهنگ کردن الزامات خود برای یک سیستم مدیریت کیفیت (QMS) با الزامات قانونی شناخته شده بین المللی برای سیستم مدیریت کیفیت (QMS) برای دستگاه ها، ISO 13485 است که توسط بسیاری از مقامات نظارتی دیگر استفاده می شود.
در 2 مارس 2022، FDA جلسه کمیته مشورتی عمومی کمیته مشاوره عملکرد خوب ساخت دستگاه را برگزار خواهد کرد. جلسه کمیته اطلاعاتی در مورد قانون پیشنهادی ارائه می دهد و فرصتی برای بحث در مورد الزامات و تأثیرات بالقوه این اصلاحیه پیشنهادی در مقررات آژانس ارائه می دهد.
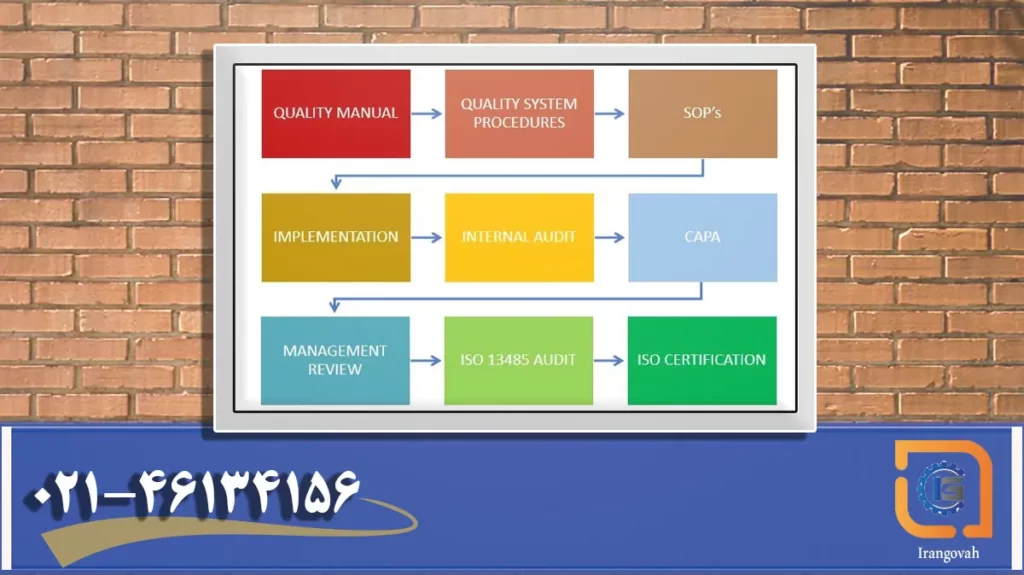
معرفی QS براساس الزامات FDA منطبق با استاندارد ایزو 13485
تولید کنندگان باید سیستم های کیفیت را ایجاد کرده و از آنها پیروی کنند تا اطمینان حاصل شود که محصولات آنها به طور مداوم الزامات و مشخصات قابل اجرا را برآورده میکنند. سیستم های کیفیت برای محصولات تحت نظارت FDA (غذا، دارو، مواد بیولوژیکی و دستگاه ها) به عنوان شیوه های تولید خوب فعلی (GMPc) شناخته میشوند.
الزامات GMPc برای دستگاه های قسمت 820 (21 CFR قسمت 820) ابتدا توسط بخش 520 (f) قانون فدرال غذا، دارو و آرایشی (قانون) مجاز شد. طبق بخش 520 (f) قانون، FDA یک قانون نهایی را در ثبت فدرال در 21 ژوئیه 1978 (43 FR 31 508) صادر کرد که الزامات GMPc را برای دستگاه های پزشکی تجویز می کرد. این آیین نامه در 18 دسامبر 1978 لازم الاجرا شد و در بخش 820 تدوین شد.
در سال 1990، FDA شروع به بازنگری مقررات GMPc برای اضافه کردن کنترل های طراحی مجاز توسط قانون تجهیزات پزشکی ایمن کرد. همچنین، آژانس بر این باور بود که برای عموم و صنعت تجهیزات پزشکی مفید است که مقررات GMPc تا حد امکان با الزامات سیستم های کیفیت مندرج در استانداردهای بین المللی قابل اجرا، به ویژه سازمان بین المللی استاندارد سازگار باشد.
سازمان بین المللی استاندارد (ISO) با انتشار استاندارد ایزو 9001 ویرایش 2015، استاندارد ایزو 13485 ویرایش 2016 میلادی را منتشر کرد که براساس الزامات QS سازمان FDA ایالات متحده مورد تایید است.
FDA با استاندارد ISO 13485:2016 منطبق می شود
سازمان غذا و داروی ایالات متحده اعلام کرده است که پس از انجام تجزیه و تحلیل مقایسه ای بین ISO 13485:2016 و مقررات فعلی سیستم کیفیت (QSR) به استاندارد ISO 13485:2016 تغییر خواهد کرد.

در یک به روزرسانی رسمی از FDA در دسامبر 2018 ، دلایل و مزایای اجرای ISO 13485 به عنوان معیار بازرسی های حسابرسی سیستم مدیریت کیفیت بیان شده است. در این ارائه ، آژانس آمده است: “این تجدید نظر در نظر گرفته شده است تا با هماهنگی نیازهای داخلی و بین المللی ، بارهای سازگاری و ضبط بر تولید کنندگان دستگاه را کاهش دهد. این اصلاحات همچنین آیین نامه را مدرن می کند. “
FDA همچنین اذعان دارد که نه تنها برای خود FDA، که باید بازرسان و سایر کارکنان خود را بازآموزی کند و همچنین الزامات بازرسی ممیزی خود را تطبیق دهد، بلکه برای شرکت های تولید تجهیزات پزشکی در ایالات متحده – به ویژه شرکت هایی که قبلاً انجام نشده اند، پیامدهایی خواهد داشت. قبلاً در برابر ISO 13485:2016 گواهی شده است.
انتقال به ISO 13485: 2016 از FDA در کنار شروع MDSAP (برنامه حسابرسی تک دستگاه پزشکی) همانطور که از IMDRF (مجمع بین المللی تنظیم کننده دستگاه های پزشکی) و اتحادیه اروپا MDR 2017/45 (تنظیم مقررات کارشناسی ارشد) خواهد بود ، خواهد بود. پارلمان اروپا و شورا). این انتقال به زودی اتفاق می افتد ، اما سازمان های تحت تأثیر قادر به تنظیم تا زمانی که تغییر سیستم مدیریت لازم ، تجزیه و تحلیل شکاف و ممیزی های داخلی را تنظیم کنند.
PECB اینجاست تا به افراد کمک کند تا آموزش ببینند و گواهینامه دریافت کنند و سازمان ها برای ممیزی و گواهینامه ISO 13485:2016 کمک کنند. این سرویس توسط IAS (سرویس اعتباربخشی بین المللی) معتبر است.