نحوه پیاده سازی ایزو 13485 چگونه است؟, متن فارسی ISO 13485
در این مقاله نحوه پیاده سازی ایزو 13485 توضیح داده شده است. پیاده سازی سیستم مدیریت کیفیت برای تولید تجهیزات پزشکی در کسب وکار شما میتواند مزایای متعددی داشته باشد. استاندارد ایزو 13485 چارچوبی را برای عملکرد مدیریت خوب ارائه می دهد که تعهد کسب و کار را به تولید دستگاه های پزشکی با کیفیت بالا نشان می دهد.
استاندارد ISO 13485 برای اطمینان از اینکه دستگاه های پزشکی، صرف نظر از اینکه ساخت کجا هستند، اطمینان و کیفیت را برای مصرف کننده ایجاد نماید، توسط سازمان ISO تدوین و منتشر شد. داشتن این استاندارد می تواند به گسترش بازار بالقوه کمک کند و مزایایی را برای تأیید نظارتی در بازارهای بزرگ مانند اتحادیه اروپا و کانادا رهبری کند. داشتن ISO 13485 همچنین می تواند تأثیر مثبتی داشته باشد که نشان دهنده تعهد سازمان به کیفیت بالا است.
کسب و کارهای بزرگتر تجهیزات پزشکی ترجیح می دهند با فروشندگانی کار کنند که سیستم مدیریت کیفیت را برای دستگاه های پزشکی پیاده سازی کرده اند و دارای گواهی ISO 13485 هستند. بازنگری در به روز رسانی این استاندارد در سال 2016 به این معنی است که شرکت ها مسئول اطمینان از انطباق هر پیمانکار فرعی با استانداردهای ISO 13485 هستند. پیمانکاران فرعی که قبلاً گواهینامه ایزو 13485 را دریافت کرده اند احتمالاً در اولویت قرار می گیرند.
مستندات استاندارد ایزو 13485 برای کمک به کارمندان برای دسترسی به اطلاعات مورد نیاز در زمانی که به آن نیاز دارند طراحی شده است. دسترسی به اطلاعات مناسب می تواند زمان و هزینه های مرتبط با توسعه محصول را کاهش دهد. مستند سازی فرآیندهای مرتبط با دستگاه های پزشکی همچنین میتواند به سازمان ها کمک کند تا یک پایگاه دانش یکپارچه ایجاد کنند. این می تواند به شناسایی مشکلات، بهبود محصول و ساده سازی فرآیند تولید کمک کند.
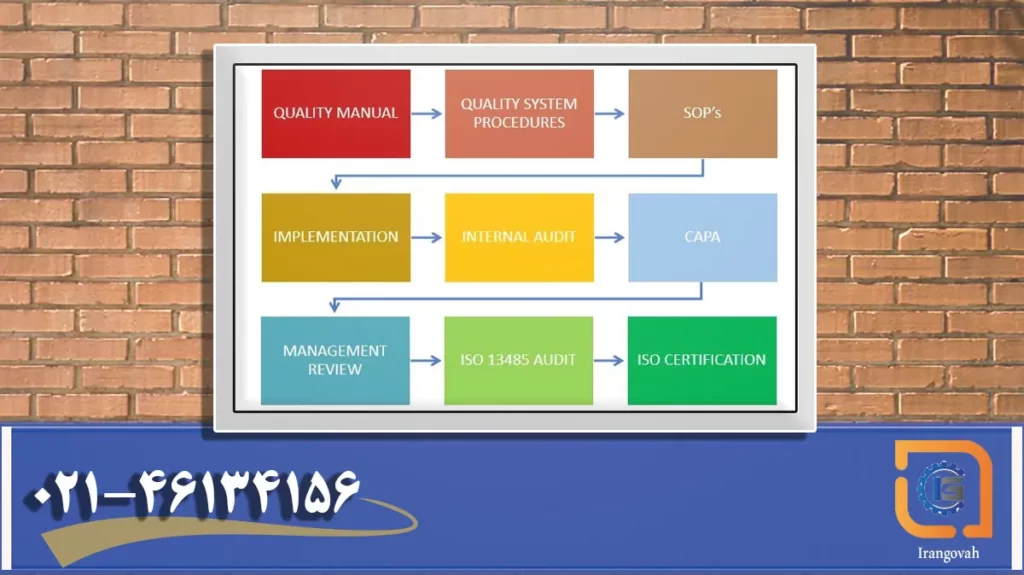
مزایای اعلام شده و کلی مزیت دیگر باعث شده شرکت های تولیدکننده تجهیزات پزشکی یا پیمانکاران فرعی جهت دریافت گواهینامه ایزو 13485 اقدام نمایند. بنابراین نحوه پیاده سازی ایزو 13485 چالش آنها جهت ممیزی و صدور گواهی ایزو 13485 است. ما سعی کرده ایم توسط این مقاله مراحل پیاده سازی ایزو 13485 را به زبان ساده توضیح دهیم.
پس برای پیاده سازی ایزو 13485 شروع کنیم.
آیا FDA با استاندارد ISO 13485:2016 منطبق می شود؟
مرحله اول برای پیاده سازی ایزو 13485, تفکر یا حسابرسی مبتنی بر ریسک
مرحله اول برای پیاده سازی ایزو 13485، ممیزی یک رویکرد فرآیندی مبتنی بر شواهد و سیستماتیک برای ارزیابی سیستم مدیریت کیفیت شما است. ممیزی به صورت داخلی و خارجی برای تأیید اثربخشی QMS انجام می شوند. حسابرسی ها نمونه ای درخشان از نحوه اتخاذ تفکر مبتنی بر ریسک در مدیریت کیفیت هستند. سه مرحله ممیزی استاندارد 13485 شامل:

حسابرسی داخلی
ممیزی داخلی یک فرصت عالی برای یادگیری در سازمان شما است. آنها زمانی را برای تمرکز روی یک فرآیند یا بخش خاص به منظور ارزیابی واقعی عملکرد آن فراهم می کنند. هدف ممیزی داخلی اطمینان از پایبندی به خط مشی ها، رویه ها و فرآیندهایی است که توسط شما، سازمان تعیین شده و تأیید انطباق با الزامات ISO 13485 است.
برنامه ریزی حسابرسی
ایجاد یک برنامه ممیزی می تواند مانند یک تمرین پیچیده به نظر برسد. بسته به مقیاس و پیچیدگی عملیات خود، می توانید ممیزی های داخلی را از هر ماه تا یک بار در سال برنامه ریزی کنید.
تفکر مبتنی بر ریسک
بهترین راه برای در نظر گرفتن فراوانی ممیزی ها، بررسی ریسک های موجود در فرآیند یا حوزه تجاری مورد حسابرسی است. هر فرآیندی که ریسک بالایی دارد، یا به این دلیل که پتانسیل بالایی برای اشتباه دارد یا به این دلیل که اگر اشتباه انجام شود، عواقب آن شدید خواهد بود، در این صورت میخواهید آن فرآیند را بیشتر از یک فرآیند کم خطر بررسی کنید. نحوه ارزیابی ریسک کاملاً به شما بستگی دارد. ISO 13485 هیچ روش خاصی را برای ارزیابی ریسک یا مدیریت ریسک دیکته نمی کند.
حسابرسی خارجی
ممیزی های شخص ثانویه معمولاً توسط مشاور ایزو یا واحد QC سازمان ها انجام می شود. ممیزی های شخص ثالث نیز میتواند توسط تنظیمکننده ها یا هر طرف خارجی دیگری که به طور رسمی در یک سازمان علاقه دارد، انجام شود. شما ممکن است کنترل کمی بر زمان و دفعات این ممیزی ها داشته باشید، با این حال ایجاد QMS خود تضمین می کند که برای ورود آنها به خوبی آماده هستید.
ممیزی صدور گواهی
ممیزی شخص ثالث توسط نهادهای خارجی، معمولاً نهادهای صدور گواهینامه معتبر ISO 13485 انجام می شود. سازمان صدور گواهی انطباق با استاندارد ایزو 13485 را ارزیابی خواهد کرد. این شامل یک نماینده از سازمان صدور گواهینامه ایزو است که از سازمان بازدید می کند و سیستم مربوطه و فرآیندهای آن را ارزیابی می کند. حفظ گواهینامه همچنین مستلزم ارزیابی مجدد دوره ای است. گواهینامه نشان می دهد که شما به کیفیت تعهد دارید.
مرحله دوم برای پیاده سازی ایزو 13485, حسابرسی مبتنی بر فرآیند
مرحله دوم برای پیاده سازی ایزو 13485 یک فرآیند تبدیل ورودی ها به خروجی ها است که به صورت مجموعه ای از مراحل یا فعالیت هایی انجام می شود که منجر به هدف (های) برنامه ریزی شده می شود. اغلب خروجی یک فرآیند به ورودی فرآیند بعدی دیگر تبدیل می شود. تعداد بسیار کمی از فرآیندها جدا از سایر فرآیندها عمل می کنند.
“فرآیند: مجموعه ای از فعالیت های مرتبط یا متقابل که از ورودی ها برای ارائه یک نتیجه مورد نظر استفاده می کنند.”
حتی حسابرسی نیز رویکردی فرآیندی دارد. با شناسایی محدوده و معیارها شروع می شود، یک مسیر اقدام روشن برای دستیابی به نتیجه ایجاد می کند و یک خروجی تعریف شده دارد (گزارش حسابرسی). استفاده از رویکرد فرآیندی برای حسابرسی همچنین تضمین می کند که زمان و مهارت های صحیح به حسابرسی تخصیص داده شده است. این باعث می شود که ارزیابی موثری از عملکرد QMS باشد.
“زمانی که فعالیت ها به عنوان فرآیندهای مرتبط با هم که به عنوان یک سیستم منسجم عمل میکنند، درک و مدیریت شوند، نتایج سازگار و قابل پیش بینی مؤثرتر و کارآمدتر به دست میآیند.”
درک چگونگی ارتباط بین فرآیندها و ایجاد نتایج می تواند به شما در شناسایی فرصت های بهبود و در نتیجه بهینه سازی عملکرد کلی کمک کند. این همچنین در مواردی که فرآیندها یا بخش هایی از فرآیندها برون سپاری میشوند نیز صدق میکند. درک اینکه دقیقاً چگونه این امر بر نتیجه تأثیر می گذارد یا می تواند تأثیر بگذارد و این موضوع به طور واضح به شریک تجاری (ارائه محصول یا خدمات برون سپاری شده) شفافیت و مسئولیت پذیری در فرآیند را تضمین می کند.
مرحله نهایی فرآیند بررسی نتیجه حسابرسی و اطمینان از استفاده مناسب از اطلاعات به دست آمده است. بررسی رسمی مدیریت فرصتی است برای تأمل در عملکرد QMS و تصمیم گیری در مورد چگونگی و مکان بهبود.
در مورد متن استاندارد ایزو 9001 بیشتر بخوانید.
متن استاندارد ISO 13485:2016 برای پیاده سازی ایزو 13485
برای پیاده سازی الزامات ایزو 13485 نیاز است که درک آگاهانه ای از استاندارد ایزو 13485 داشته باشید. پس بیاید متن استاندارد ایزو 13485 را بررسی کنیم. ما متن فارسی استاندارد ISO 13485 را برای شما ترجمه کرده ایم.

بند 1: محدوده
در بند یک ISO 13485 هدف این است که اگر سازمان شما با تهیه تجهیزات پزشکی درگیر است، ISO 13485 الزامات QMS را تعیین می کند. چه محصول خاصی داشته باشید چه نداشته باشید، الزامات بر توانایی سازمان شما برای ارائه مداوم محصولی که الزامات مشتری و الزامات قانونی قابل اجرا را برآورده می کند، تمرکز دارد.
دامنه ISO 13485 فقط برای تولیدکنندگان نیست، بلکه اشخاص ثالث مانند کسانی که در زنجیره تامین یا ارائه خدمات دخیل هستند، می توانند اقدام به پیاده سازی ایزو 13485 و اخذ گواهی ISO 13485 نمایند. این بخش تصریح میکند که این استاندارد برای همه سازمان های درگیر در چرخه عمر محصولات پزشکی، از جمله طراحی، تعمیر، نصب، نگهداری و ذخیره سازی تجهیزات پزشکی قابل اجرا است.
بند 2: مراجع هنجاری
“مرجع هنجاری” به سادگی به معنای هر سند دیگری است که در استاندارد سیستم مدیریت ارجاع داده می شود. در مورد ISO 13485:2016، ارجاعات زیادی به ISO 9000:2015، سیستم های مدیریت کیفیت – مبانی و واژگان وجود دارد. ISO 9000:2015 تنها مرجع هنجاری برای ISO 13485 است. درک این استاندارد و اعمال آن در ISO 13485 ارزشمند است.

بند 3: اصطلاحات و تعاریف
شرایط و تعاریف ارائه شده در استاندارد ایزو 9001 اعمال می شود. اما توجه داشته باشید که تعاریف ارائه شده برای ISO 13485 ممکن است به دلیل کاربرد بخش تجهیزات پزشکی با تعریف ISO 9000:2015 متفاوت باشد. هنگامی که اسناد سیستم مدیریت کیفیت خود را می نویسید، نیازی به استفاده از این اصطلاحات دقیق ندارید. با این حال، اگر بتوانید اصطلاحاتی را که استفاده کرده اید تعریف کنید، به روشن شدن معنا و قصد کمک می کند. ارائه یک واژه نامه در اسناد سیستم شما ممکن است مفید باشد.
مثال هایی برای پیاده سازی ایزو 13485 مرتبط با بند 3 (اصطلاحات و تعاریف) به شرح زیر است:
- نماینده مجاز: شخص حقیقی یا حقوقی مستقر در یک کشور یا حوزه قضایی که از سازنده دستور کتبی دریافت کرده است تا از طرف او برای وظایف مشخص شده در رابطه با تعهدات سازنده تحت قوانین آن کشور یا حوزه قضایی اقدام کند.
- ارزیابی بالینی: ارزیابی و تجزیه و تحلیل داده های بالینی مربوط به یک دستگاه پزشکی برای تأیید ایمنی بالینی و عملکرد دستگاه در صورت استفاده طبق خواسته سازنده.
- شکایت: ارتباطات کتبی، الکترونیکی یا شفاهی که ادعا میکند نقص های مربوط به هویت، کیفیت، دوام، قابلیت اطمینان، قابلیت استفاده، ایمنی یا عملکرد یک دستگاه پزشکی که از کنترل سازمان خارج شده است یا مربوط به خدماتی است که بر عملکرد تأثیر میگذارد.
- توزیع کننده: شخص حقیقی یا حقوقی در زنجیره تأمین که از طرف خود، دسترسی یک دستگاه پزشکی را به کاربر نهایی افزایش می دهد.
- دستگاه پزشکی قابل کاشت: دستگاه پزشکی که فقط با مداخله پزشکی یا جراحی قابل برداشتن است و برای:
- به طور کامل یا جزئی وارد بدن انسان یا یک روزنه طبیعی شود.
- جایگزینی سطح اپیتلیال یا سطح چشم باشد.
- پس از عمل حداقل 30 روز در بدن باقی بماند.
- واردکننده: شخص حقیقی یا حقوقی در زنجیره تأمین که برای اولین بار در زنجیره تأمین تجهیزات پزشکی تولید شده در کشور یا حوزه قضایی دیگر را در کشور یا حوزه قضایی که قرار است به بازار عرضه شود، عرضه میکند.
- برچسب: برچسب، دستورالعمل استفاده، و هر گونه اطلاعات دیگری که مربوط به شناسایی، توضیحات فنی، هدف مورد نظر و استفاده مناسب از دستگاه پزشکی است، اما اسناد حمل و نقل را شامل نمی شود.
- چرخه عمر: تمام مراحل در زندگی یک دستگاه پزشکی، از مفهوم اولیه تا از کار انداختن و دفع نهایی.
- تولیدکننده: شخص حقیقی یا حقوقی که مسئولیت طراحی و یا ساخت دستگاه پزشکی را به قصد در دسترس قرار دادن دستگاه پزشکی برای استفاده به نام خود دارد. آیا چنین دستگاه پزشکی توسط خود آن شخص یا از طرف او توسط شخص یا افراد دیگری طراحی و یا ساخته شده است یا خیر.
- دستگاه پزشکی: ابزار، دستگاه، ماشین، تجهیزات یا ایمپلنت، معرف برای استفاده در شرایط آزمایشگاهی، نرم افزار، مواد یا سایر محصولات مشابه یا مرتبط که توسط سازنده برای استفاده به تنهایی یا ترکیبی برای انسان در نظر گرفته شده است. برای یک یا چند مورد از اهداف پزشکی خاص همانند:
- تشخیص، پیشگیری، نظارت، درمان یا کاهش بیماری.
- تشخیص، نظارت، درمان، تخفیف یا جبران آسیب.
- بررسی، جایگزینی، اصلاح یا پشتیبانی آناتومی یا یک فرآیند فیزیولوژیکی.
- حمایت یا حفظ زندگی.
- کنترل لقاح.
- ضد عفونی وسایل پزشکی.
- ارائه اطلاعات از طریق بررسی آزمایشگاهی نمونه های مشتق شده از بدن انسان.
و عمل مورد نظر اولیه خود را از طریق ابزارهای دارویی، ایمونولوژیکی یا متابولیک در بدن انسان یا روی بدن انسان انجام نمی دهد، اما ممکن است با چنین وسایلی در عملکرد مورد نظر خود کمک شود.
- خانواده دستگاه های پزشکی: گروهی از دستگاه های پزشکی که توسط یا برای یک سازمان تولید میشوند و دارای ویژگی های اولیه طراحی و عملکرد مرتبط با ایمنی، استفاده مورد نظر و عملکرد هستند.
- ارزیابی عملکرد: ارزیابی و تجزیه و تحلیل داده ها برای ایجاد یا تأیید توانایی یک دستگاه پزشکی تشخیصی آزمایشگاهی برای دستیابی به استفاده مورد نظر.
- نظارت پس از بازار: فرآیندی سیستماتیک برای جمع آوری و تجزیه و تحلیل تجربیات به دست آمده از دستگاه های پزشکی که در بازار عرضه شده اند.
- محصول: نتیجه یک فرآیند.
- محصول خریداری شده: محصولی که توسط طرفی خارج از سیستم مدیریت کیفیت سازمان ارائه می شود.
- ریسک: ترکیبی از احتمال وقوع آسیب و شدت آن آسیب.
- مدیریت ریسک: کاربرد سیستماتیک سیاست ها، رویه ها و شیوه های مدیریت برای وظایف تحلیل، ارزیابی، کنترل و نظارت بر ریسک.
- سیستم مانع استریل: حداقل بسته ای که از ورود میکروارگانیسم ها جلوگیری می کند و اجازه می دهد تا محصول در محل استفاده بدون عفونی شود.
- دستگاه پزشکی استریل: دستگاه پزشکی که برای برآوردن الزامات استریل در نظر گرفته شده است.

بند 4: سیستم مدیریت کیفیت
در این بخش، بند 4 به الزامات مستندسازی رویه های مربوط به فرآیند مدیریت کیفیت میپردازد.
4.1 سیستم مدیریت کیفیت – الزامات کلی
بسیاری از الزامات، دیدگاه کلی که بیشتر در بندهای خاص گسترش یافته است، می توانند به اختصار به شرح زیر بیان شوند:
- الزامات استاندارد و مقررات قابل اجرا را برآورده کنید.
- نقش های انجام شده سند (حوزه).
- فرآیندهای مورد نیاز برای QMS و تعاملات آنها را تعیین کنید.
- اعمال کنترل ها بر اساس ریسک، از جمله فرآیندهای بیرونی (که همچنین نیاز به توافقنامههای کیفی مکتوب دارند).
- معیارهایی را برای دستیابی به هر فرآیند تعیین کنید.
- اطمینان از در دسترس بودن منابع و اطلاعات برای عملیات و نظارت.
- اثربخشی فرآیند را با عمل حفظ کنید.
- نظارت، اندازه گیری و تجزیه و تحلیل.
- سوابق را نگه دارید.
- تغییر را کنترل کنید.
- نرم افزار مورد استفاده در QMS را اعتبارسنجی کنید.
4.2 سیستم مدیریت کیفیت – الزامات مستندسازی
موارد زیر را مستند کنید:
- کتابچه راهنمای.
- پرونده های تجهیزات پزشکی یا سوابق دسته ای و پرونده های فنی یا مشخصات.
- رویه ها و سوابق مورد نیاز توسط این استاندارد، مقررات، مشتریان و سایر الزامات شناسایی شده.
- اقدامات مستندسازی خوب به عنوان سوابق مورد نیاز است و تغییرات در آنها باید خوانا باقی بماند.

بند 5: مسئولیت مدیریت
بخش 5 نیاز به مدیریت عالی را برای کمک به پیاده سازی ایزو 13485 و نگهداری سیستم مدیریت کیفیت متمرکز می کند. علاوه بر برنامه ریزی QMS، مدیریت ارشد باید در بررسی سیستم مشارکت داشته باشد تا اطمینان حاصل شود که الزامات را برآورده می کند و نشان می دهد که پیشرفت وجود دارد.
تعهد مدیریت
شواهدی مبنی بر تعهد به اجرا و توسعه QMS باید توسط مدیریت ارشد نشان داده شود. مدیریت عالی فرد یا گروه هایی از افراد است که کنترل سازمان شما را در بالاترین سطح در اختیار دارند. شواهدی از تعهد مدیریت ارشد را می توان از طریق ارتباط با سازمان برای برآوردن نیازهای مشتری و مقررات تنظیم شده، ایجاد خط مشی کیفیت، اطمینان از ایجاد اهداف کیفیت، انجام بررسی های مدیریت و اطمینان از در دسترس بودن منابع نشان داد.
تمرکز بر مشتری
مدیریت ارشد باید اطمینان حاصل کند که الزامات مشتری و مقررات رعایت شده است. مهم است که مدیریت ارشد اطمینان حاصل کند که اقدامات برای رسیدگی به هرگونه نیاز، خطر و فرصت اجرا می شود. اگر این مورد نیازهای مشتری یا الزامات نظارتی را برآورده نکند، رویکرد Plan-Do-Check-Act برای بهبودهای بیشتر تا زمانی که آنها برآورده شوند ادامه می یابد.
خط مشی کیفیت
این بخش بیان می کند که مدیریت ارشد مسئول تعریف خط مشی کیفیت و اطمینان از خط مشی کیفیت هستند: همسو با هدف سازمان. تعهد به پیروی از الزامات و حفظ اثربخشی را نشان می دهد. چارچوبی برای بررسی اهداف کیفی ارائه می کند. به طور کامل درک شده و در سراسر سازمان در ارتباط است. و برای تداوم مناسب بودن بررسی شد.
تعهد مدیریت ارشد به کیفیت باید از طریق خط مشی کیفیت ابلاغ شود. اهداف واضح باید در خط مشی کیفیت نشان داده شود تا نشان دهد که سازمان شما متعهد به اجرای خط مشی است و اهداف باید با سازمان شما و مشتریان شما مرتبط باشد.
برنامه ریزی
هدف کیفیت تعیین شده توسط مدیریت ارشد باید واقع بینانه باشد و در عملکردها و سطوح مرتبط در سراسر سازمان شما ایجاد شود. اهدافی مانند برآوردن الزامات مشتری و نظارتی برای تجهیزات پزشکی یا کاهش خطاها و غیره نمونه هایی از نتایج قابل دستیابی و قابل اندازه گیری برای QMS هستند. اگرچه نیازی نیست که اهداف توسط مدیریت ارشد شخصاً انجام شود، اما اطمینان از اینکه اقداماتی برای دستیابی به اهداف انجام می شود، همچنان مسئولیت مدیریت ارشد است.
برنامه ریزی در مراحل اولیه توسعه و اجرا صورت می گیرد، با این حال، از آنجایی که اهداف می توانند در طول زمان تغییر کنند، برنامه ریزی ممکن است ادامه داشته باشد و به QMS کمک کند تا در حین ایجاد تغییرات و پس از آن موثر باشد. ملاحظات مبتنی بر ریسک نیز به دلیل تأثیراتی که تغییرات ممکن است بر QMS شما باشد، در برنامه ریزی گنجانده خواهد شد.
نمونه هایی از ورودی ها در برنامه ریزی QMS
- خط مشی کیفیت.
- اهداف کیفیت.
- الزامات نظارتی و غیره.
نمونه هایی از خروجی های برنامه ریزی QMS
- راهنمای کیفیت.
- تجزیه و تحلیل فاصله.
- برنامه های اقدام و غیره.
مسئولیت، اقتدار و ارتباط
مسئولیت ها و اختیارات باید برای آن نقشهایی که بر کیفیت تأثیر میگذارند، ایجاد، مستند و ابلاغ شود تا ارتباط متقابل بین هر نقش را مستند کند. این مستندات بخشی از QMS شما را تشکیل می دهد و باید کنترل شود.
مدیریت ارشد مسئولیت را به یکی از اعضای مدیریت به عنوان نماینده واگذار می کند. مسئولیتهای نماینده میتواند کاملاً به فعالیتهای QMS مرتبط باشد یا در ارتباط با سایر مسئولیت های درون سازمان باشد. نباید بین این مسئولیت ها تضاد منافع وجود داشته باشد. مدیریت ارشد باید فرآیندهایی را ایجاد کند که ارتباطات مناسب را در مورد اثربخشی QMS در سازمان تضمین کند. این ارتباط باید به هر دو صورت انجام شود و به پرسنل اجازه دهد سؤالات خود را بپرسند و در مورد بهبود QMS پیشنهاد دهند.
بررسی مدیریت
بررسی مدیریت یک عنصر اساسی از یک سیستم مدیریت کیفیت است. این نقطه رسمی است که در آن مدیریت ارشد اثربخشی QMS را بررسی می کند و از همسویی آن با جهت استراتژیک اطمینان می یابد. ضروری نیست که یک جلسه بازنگری مدیریت برگزار شود که دستور کار کامل را پوشش دهد. اگر در حال حاضر مجموعه ای از جلسات را برگزار می کنید که ورودی های بین آنها را پوشش می دهد، نیازی به تکرار نیست.
با این حال، ممکن است متوجه شوید که یک نمای تصویر بزرگ با در نظر گرفتن ورودی های بررسی مدیریت در یک جلسه به جای جدا کردن آنها آسان تر می شود. این واقعاً به اندازه و ساختار سازمان شما و اینکه چه کسی در هر یک از جلسات شرکت می کند بستگی دارد.
جلسات بازنگری مدیریت معمولاً به عنوان یک رویداد سالانه برگزار می شود، با این حال مانند ممیزی داخلی، فراوانی آنها توسط ISO 9001:2015 مشخص نشده است. این به شما بستگی دارد که تصمیم بگیرید. در طول اجرا و مراحل اولیه تطبیق با QMS، ممکن است برگزاری جلسات بیشتر معقول باشد. شما باید اطلاعات مستندی را در مورد بررسی های مدیریت خود حفظ کنید، در صورت انجام تماس های کنفرانسی، اینها معمولاً صورتجلسه های جلسه یا شاید ضبط تماس ها هستند.

بند 6: مدیریت منابع
بخش 6 کوتاه است و لزوم کنترل همه منابع را پوشش می دهد. این شامل منابع انسانی، زیرساخت ها و محیط کار می شود.
تامین منابع
الزامات تامین منابع کافی باید توسط سازمان تعیین شود، این الزامات عبارتند از: اجرای QMS و حفظ اثربخشی آن و برآوردن نیازهای نظارتی و مشتری. صرف نظر از اینکه فرآیندهای مرتبط توسط طرف خارجی یا سازمان شما انجام می شود، مسئولیت تامین منابع با سازمان شما خواهد بود. بررسی نیازهای منابع شما باید به طور منظم انجام شود و معمولاً بخشی از بررسی مدیریت است، زمانی که یک قرارداد جدید در نظر گرفته می شود، یک استراتژی تجاری جدید در نظر گرفته می شود و زمانی که الزامات نظارتی تغییراتی وجود دارد.
منابع انسانی
افراد مهم ترین منبع برای یک سازمان هستند و برای انجام کار به افراد کافی با شایستگی های مناسب نیاز دارند. نقش هایی که بر کیفیت تأثیر می گذارند باید شایستگی لازم را داشته باشند و آموزش مناسب برای مهارت های مورد نیاز برای آن نقش ها را داشته باشند. سازمان باید فرآیندهای ایجاد شایستگی، ارائه آموزش های مورد نیاز و اطمینان از آگاهی پرسنل را مستند کند.
زیر ساخت
این شامل تعیین، تهیه و نگهداری محل، سخت افزار، نرم افزار، حمل و نقل، ذخیره سازی، فناوری و غیره است که برای دستیابی به انطباق با محصول و فرآیند مورد نیاز است. این امر از مخلوط شدن محصول و مدیریت امن محصولات جلوگیری می کند.
محیط کار و کنترل آلودگی
این به معنای عالی بودن فضای باز نیست. این به معنای فراهم کردن محیطی است که برای آنچه میخواهید به دست آورید مناسب است. چه یک کارخانه، دفتر، استودیو یا هر نوع فضای کاری دیگری، مطمئن شوید که فضای مناسبی را برای ایجاد شرایط محیطی مناسب برای نظارت و کنترل محصولات تولید شده دارید تا از آسیب یا آلودگی محصول جلوگیری کنید. کنترل ها، پارامترها و شاخص های کافی، حفظ بهداشت و ایمنی مناسب و غیره همگی به یک محیط کاری مؤثر کمک میکنند.
سازمان ها باید الزامات را به منظور کنترل محصولات آلوده و جلوگیری از آلودگی محیط کار، کارکنان یا محصولات، برنامه ریزی و مستند کنند. در این بخش همچنین برای دستگاههای پزشکی استریل، الزامات باید برای کنترل آلودگی با میکروارگانیسم ها و حفظ پاکیزگی لازم در طول فرآیندهای مونتاژ یا بسته بندی مستند شود.

بند 7: تحقق محصول
بخش 7 به الزامات محصول مربوط به برنامه ریزی و ایجاد محصول یا خدمات مربوط می شود. این شامل الزاماتی مانند برنامه ریزی، طراحی و توسعه، خرید و کنترل تجهیزات نظارت و اندازه گیری است. این استاندارد اجازه می دهد تا الزامات این بخش در صورتی که برای سازمان قابل اجرا نیستند، کنار گذاشته شوند.
برنامه ریزی برای تحقق محصول
برای یک سازمان مهم است که برای تحقق محصول برنامه ریزی و توسعه یابد و فرآیندهای مورد نیاز را مستند کند. این برنامه ها باید با الزامات سایر فرآیندهای QMS سازگار و همسو باشند. علاوه بر این، سازمان باید به فعالیت هایی مانند فعالیت های جابجایی، ذخیره سازی، توزیع و ردیابی بپردازد.
این بند همچنین نیاز به فرآیند ارزیابی ریسک سند در تولید را بیان می کند. این تقریباً یک نظر گذرا است اما در واقع اجرای آن بسیار مهم است. ایران گواه راه خوبی برای رفع این نیاز است. همچنین به ISO 14971، استاندارد ارزیابی خطر در دستگاههای پزشکی اشاره میکند که ممکن است مفید باشد.
فرآیندهای مرتبط با مشتری
سازمان شما باید الزامات مربوط به انتظارات مشتری و تعیین هر گونه آموزش کاربر مورد نیاز برای اطمینان از عملکرد مشخص و استفاده ایمن از دستگاه های پزشکی را تعیین کند. قبل از تعهد به عرضه محصولات به مشتری، باید الزامات مربوط به محصولات را بررسی کرد تا اطمینان حاصل شود که نیازهای مشتری کاملاً درک شده است. باید برنامه ها و اسناد ارتباط با مشتریان و مراجع نظارتی وجود داشته باشد. ارتباط با مشتریان در رابطه با: اطلاعات محصول؛ پرس و جو، قراردادها و سفارشات؛ بازخورد؛ و اطلاعیه ها.
طراحی و توسعه
هنگام طراحی یا توسعه محصول یا خدمات خود، باید الزامات قانونی، هر استاندارد دیگری که ممکن است اعمال شود، پیامدهای بالقوه شکست و هر چیزی که در طول سفر توسعه آموخته اید را در نظر بگیرید.
از شما خواسته می شود که اطلاعات مستند در مورد ورودی های طراحی را حفظ کنید. کنترلهای طراحی و توسعه به هر نقطه لمسی در طول فرآیند طراحی اشاره دارد که در آن تأیید، تأیید، آزمایش، مجوز یا هر شکلی از امضا یا پذیرش ممکن است مورد نیاز باشد.
از شما خواسته می شود که اطلاعات مستند در مورد فعالیت های کنترل طراحی و توسعه را حفظ کنید. هنگامی که ورودی های طراحی و کنترل های لازم برای اطمینان از انطباق را تعیین کردید، باید اطمینان حاصل کنید که خروجی های شما این الزامات را برآورده می کند. این مکانی است که می توانید سوابق نظارت، اندازه گیری، قابلیت ردیابی (مانند مواد یا اندازه گیری ها) و معیارهای پذیرش را نیز در آن نگهداری کنید.
این می تواند به صورت صورتحساب مواد، مشخصات فنی یا کتابچه راهنمای کاربر، راهنمای کاربر، کتابچه راهنمای فرآیند، راهنمای سیستم یا قرارداد سطح خدمات باشد. هر گونه تغییر در طراحی و توسعه محصول یا خدمات باید شناسایی، کنترل، ثبت و اطلاع رسانی شود تا اطمینان حاصل شود که محصول یا خدمات مطابق با مشتری و سایر الزامات قابل اجرا همراه با مجوز واضح برای تغییرات است.
برای کنترل تغییرات طراحی و توسعه نیاز به مستندسازی رویه ها وجود دارد. اهمیت تغییرات باید از طریق عملکرد، عملکرد، قابلیت استفاده، ایمنی و الزامات نظارتی قابل اجرا برای دستگاه پزشکی تعیین شود. قبل از ایجاد هر گونه تغییر، باید بررسی، تایید، تایید و تایید شود. برای هر نوع دستگاه پزشکی یا خانواده تجهیزات پزشکی، یک فایل طراحی و توسعه باید نگهداری شود.
خرید
فرآیند خرید باید با رویه های مستند مطابقت داشته باشد. ضوابط ارزیابی و انتخاب تامین کنندگان باید توسط سازمان تعیین شود و باید بر اساس موارد زیر باشد: توانایی تامین کننده برای ارائه محصولی که الزامات سازمان را برآورده کند. عملکرد تامین کننده؛ تأثیر محصول خریداری شده بر کیفیت دستگاه پزشکی؛ و خطر مرتبط با دستگاه پزشکی. اطلاعات خرید محصول مورد خرید را توصیف و ارجاع می دهد و شامل مشخصات می باشد. الزامات پذیرش محصول، رویه ها، فرآیندها و تجهیزات؛ صلاحیت پرسنل تامین کننده.
اطلاعات خرید باید شامل یک توافق نامه کتبی نیز باشد مبنی بر اینکه تامین کننده باید قبل از اجرای هرگونه تغییری که بر توانایی محصول خریداری شده برای برآورده کردن الزامات خرید مشخص شده تأثیر می گذارد، سازمان را از هرگونه تغییر در محصول مطلع کند. راستی آزمایی برای اطمینان از برآورده شدن الزامات با محصولات خریداری شده است، اگر تغییراتی در محصول خریداری شده وجود داشته باشد، سازمان باید تعیین کند که آیا این تغییرات بر فرآیند محصول یا دستگاه پزشکی تأثیر میگذارد یا خیر.
تولید و ارائه خدمات
وقتی صحبت از تولید و ارائه خدمات می شود، باید کنترل های مناسب برنامه ریزی، اجرا و نظارت شود، اینها باید ایجاد و مستند شود. این برای اطمینان از سازگاری در روش های تولید و خروجی است.
الزامات تمیزی محصول، فعالیت های نصب، فعالیت های خدماتی باید تعریف و مستند شوند. در مواردی که سازمان نیاز به ارائه دستورالعمل هایی دارد که به نصاب اجازه می دهد عملکرد صحیح دستگاه را تأیید کند. در صورت وجود نیاز مشخص برای سرویس دهی یک دستگاه پزشکی، سازمان باید رویه های سرویس، مواد مرجع و اندازه گیری های مرجع را برای انجام فعالیت های خدماتی مستند کند.
باید سوابقی برای پارامترهای فرآیند استریل سازی که برای هر دسته استریل سازی استفاده میشود، نگهداری شود. اگر به دنبال اطلاعات اضافی در مورد استریلیزاسیون هستید، این را می توان در ISO 11135 و موارد دیگر یافت. سازمان باید هر فرآیندی را برای تولید و ارائه خدمات تأیید کند که در آن خروجی حاصل با نظارت یا اندازه گیری بعدی قابل تأیید نیست یا تأیید نمیشود و در نتیجه، کمبودها تنها پس از استفاده از محصول یا ارائه خدمات آشکار میشوند.
فرآیندهای استریلیزاسیون را نمی توان با بازرسی و آزمایش دستگاه پزشکی تأیید کرد. فرآیندهایی مانند این باید مطابق با رویه های مستند انجام شوند و قبل از استفاده باید اعتبار سنجی شوند. آنها باید از نزدیک کنترل و نظارت شوند. شناسایی محصولاتی مانند مواد اولیه، اجزاء و تجهیزات پزشکی مهم است، به این دلیل که این بدان معناست که مواد را می توان در سراسر تولید کنترل کرد، می تواند امتیاز محصول، وضعیت و الزامات ایمنی و غیره را نشان دهد. رویه ها باید میزان ردیابی را مطابق با الزامات قانونی قابل اجرا و سوابقی که باید نگهداری شوند، تعریف کنند.
اسناد الزامات خاص برای تجهیزات پزشکی قابل کاشت باید شامل سوابق اجزاء باشد. مواد و شرایط محیط کار مورد استفاده. استفاده از شناسایی محصول بر اساس تعداد دسته یا سریال امکان ردیابی به جلو و عقب را فراهم می کند. شناسایی، تأیید، حفاظت و حفاظت از اموال مشتری باید در زمانی که محصول تحت کنترل سازمان است یا توسط سازمان مورد استفاده قرار می گیرد، توسط سازمان ارائه شود. سازمان مسئول گزارش هر گونه مفقودی، آسیب یا غیر قابل تشخیص به مشتری است و سوابق را حفظ می کند.
حفظ انطباق محصول با الزامات در طول پردازش، ذخیره سازی، جابجایی و توزیع باید دارای رویه های مستند باشد. هنگامی که محصول در معرض شرایط مورد انتظار قرار می گیرد، محصولات باید توسط سازمان در برابر تغییر، آلودگی یا آسیب محافظت شوند. این امر در حین پردازش، ذخیره سازی، جابجایی و توزیع است، برای محافظت از محصول می توان این کار را از طریق طراحی و ساخت بسته بندی و ظروف حمل و نقل مناسب و مستندسازی الزامات برای شرایط خاص مورد نیاز در صورتی که بسته بندی به تنهایی نتواند حفظ کند، انجام داد.
کنترل تجهیزات مانیتورینگ و اندازه گیری
نظارت و اندازهگیری که باید انجام شود و تجهیزات آن برای ارائه شواهدی مبنی بر انطباق محصول با الزامات تعیینشده باید مستند باشد. کالیبراسیون یا تأیید باید مطابق با روش های مستند نیز انجام شود. رویه های اعتبار سنجی کاربرد نرم افزار کامپیوتری مورد استفاده برای نظارت و اندازه گیری نیازمندی ها باید مستند باشد.

بند 8: اندازه گیری، تجزیه و تحلیل و بهبود
این بخش به نیاز به نظارت بر محصولات برای اطمینان از مطابقت با استانداردهای کیفی مورد نیاز می پردازد. این فرآیندها برای اطمینان از اینکه سیستم مدیریت کیفیت طبق برنامه کار می کند و برای ایجاد هرگونه تغییر مورد نیاز استفاده می شود.
پایش و اندازه گیری
درس های زیادی در این راه در تجارت آموخته می شود. بسیاری از این درس ها را فقط می توان از طریق تجربه و حضور در آن زمان آموخت. این نوع دانش برای سازمان ارزشمند می شود، بنابراین درک و به اشتراک گذاری این یادگیری منطقی است.
داده های جمع آوری شده مانند بازخورد از فعالیت های تولید و پس از تولید و شکایات از چندین منبع مانند توزیع کنندگان و تامین کنندگان میتواند به عنوان ورودی در مدیریت ریسک استفاده شود، زیرا میتواند موقعیت های خطرناک پیش بینی نشده قبلی و غیره را آشکار کند.
گزارش به رگولاتورها
تولیدکنندگان و توزیع کنندگان دستگاه های پزشکی به دلیل الزامات نظارتی (هشیاری و PMS) به فرآیندهای رسمی برای این امر نیاز دارند، اما حتی تأمین کنندگان نیز باید این نیاز را تا حدی برآورده کنند. ممکن است یک سازمان نیاز به گزارش به تنظیم کننده ها داشته باشد، حتی اگر بعید باشد، و آنها باید اعلام کنند که در صورت نیاز، از جمله نگهداری سوابق، این کار را انجام خواهند داد.
حسابرسی های داخلی
ISO 13485:2016 تعیین می کند که ممیزی داخلی باید در فواصل زمانی برنامه ریزی شده انجام شود. این شما هستید که سازمان تصمیم می گیرید که این فواصل چقدر باشد. به عنوان نشانه، ممکن است بخواهید تمام فرآیندها را حداقل یک بار در یک دوره سالانه ممیزی کنید، در حالی که فرآیندهای پرخطر بیشتر ممیزی می شوند. هدف حسابرسی داخلی دو جنبه است. ابتدا بررسی کنید که سیستم مدیریت با الزامات مشخص شده توسط شما، سازمان در صورت لزوم برای عملیات شما مطابقت دارد. ثانیاً برای اطمینان از انطباق با الزامات ISO 13485:2016.
فرکانس حسابرسی نیز باید تحت تأثیر نتایج ممیزی های قبلی باشد و هر تغییری که می دانید ممکن است بر روند تأثیر بگذارد. بنابراین، اگر یک فرآیند یا منطقه مشکل دار دارید، منطقی است که آن را برای مدتی بیشتر ممیزی کنید تا زمانی که راه حلی اجرا شود و اثربخش دیده شود. نکته کلیدی دیگر این است که یک حسابرس نمی تواند کار خود را حسابرسی کند. ممکن است لازم باشد یک تیم حسابرسی داشته باشید تا بخش کیفیت فرآیندهای خود را ممیزی نکند.
ممیزی داخلی فرصتی عالی برای صرف مدتی برای بررسی یک فرآیند یا حوزه خاص و ارزیابی عملکرد آن است. این یک راه ایده آل برای یافتن زمینه هایی برای بهبود و رفع مشکلات احتمالی قبل از وقوع است. حسابرسی های داخلی را به عنوان نگه داشتن انگشت شما روی نبض سازمانتان در نظر بگیرید. یافته های حسابرسی داخلی باید به مدیریت مربوطه گزارش شود و طبیعتاً بخشی از دستور کار بررسی مدیریت باشد. در صورت لزوم، اقدامات اصلاحی باید بدون تأخیر بی مورد انجام شود.
اگر یک راه حل بلند مدت نیاز به برنامه ریزی قابل توجه و شاید تأیید بودجه دارد، در نظر بگیرید که آیا یک اصلاح کوتاه مدت ممکن و مناسب است یا خیر.
کنترل محصول غیر منطبق
با برنامه ریزی و بررسی مناسب، شکست ها و عدم انطباق ها باید حداقل باشد. با این حال، آنها می توانند و هنوز هم رخ می دهند. اگر در هر مرحله از فرآیند مشکلی پیش آمد، باید بتوانید این موضوع را شناسایی کنید، آن را جدا کنید و در صورت امکان از رسیدن آن به مشتری جلوگیری کنید. شما ممکن است از طریق اصلاح فوری، قرنطینه یا با گرفتن امتیاز از مشتری، از رسیدن یک محصول یا خدمات ناسازگار به مشتری خود جلوگیری کنید.
اگر مشکلی پس از عرضه محصول یا خدمات به مشتری شناسایی شود، ممکن است لازم باشد بتوانید فراخوانی محصول را اجرا کنید یا حداقل شناسایی کنید که چه کسی کالا یا خدمات معیوب را دریافت کرده است. قابلیت ردیابی در اینجا کلیدی است، بنابراین سوابق شما باید واضح و به روز باشند. شما باید اطلاعات مستند در مورد عدم انطباق ها را حفظ کنید، از جمله آنچه رخ داده است، اقدامات اصلاحی انجام شده، هر گونه امتیاز به دست آمده و اینکه چه کسی مجوز اقدامات برای حل این مشکل را داده است.
تجزیه و تحلیل داده ها
یک نیاز جدید برای مستندسازی نحوه مناسب بودن تکنیکهای آماری و روشهای اندازهگیری اضافه میکند.
بهبود
شناسایی و اجرای هرگونه تغییر لازم برای اطمینان و حفظ تناسب سیستم مدیریت کیفیت به منظور حذف یا کاهش عدم انطباق یا عدم انطباق بالقوه طراحی شده است. اقدامات اصلاحی برای جلوگیری از تکرار هرگونه عدم انطباق و اقدامات پیشگیرانه باید انجام شود. برای جلوگیری از هرگونه عدم انطباق بالقوه این امر می تواند از طریق بررسی عدم انطباق، تعیین علت (ها)، ارزیابی نیاز به اقدام برای جلوگیری از تکرار عدم انطباق، برنامه ریزی، مستندسازی و اجرای اقدام، بررسی اثربخشی اقدام انجام شده انجام شود.
یک اقدام پیشگیرانه را می توان به عنوان یک اقدام یا فرصت بهبود در زبان ISO 9001 در نظر گرفت و نباید با اقدامات اصلاحی (که توسط یک NC برای جلوگیری از تکرار آن انجام می شود) اشتباه گرفته شود.
در مورد اخذ گواهینامه ایزو 13485 بیشتر بدانید.
ساده سازی مراحل پیاده سازی ایزو 13485
نکات مهم ساده سازی حداکثری مراحل پیاده سازی ایزو 13485 خود برای تولید تجهیزات پزشکی:
- با «چرا» شروع کنید. مطمئن شوید که دلایل شما برای اجرای QMS وجود دارد.
- با جهت استراتژیک شما همسو باشد در غیر این صورت ممکن است ناپایدار شود.
- همه را درگیر کنید. لازم نیست همه آنها تصمیم گیرنده شوند، اما مطمئن شوید که ارتباط شما با همه مرتبط است. مشارکت کلید موفقیت است.
- اطمینان حاصل کنید که اهداف کیفی شما هوشمند هستند (مشخص / قابل اندازه گیری / قابل دستیابی / واقع بینانه / بازه زمانی)
- PFMEA یک روش بالقوه بسیار قوی برای نشان دادن ارزیابی و کنترل ریسک است و همانطور که بسیاری از بندهای استاندارد به ریسک به عنوان روشی برای تعیین سطح کنترل اشاره میکنند که میتواند از تصمیم گیری حمایت کند.
- این راهنما باید به عنوان یک سند پست علامت، شامل محتوایی که باید انجام دهد (محدوده، نمودار جریان فرآیند عملیات، شرح یا نمودار ساختار سند) کار کند و سپس به رویه ها و نحوه تعامل آنها با الزامات بند اشاره کند. با کپی کردن استاندارد یک سند متراکم ایجاد نکنید، اگر به سادگی از استاندارد کلمه به کلمه کپی کند، به عنوان یک سند برای کارکنان مفیدتر خواهد بود.
- با استفاده از مجوزهای دسترسی، از اسناد الکترونیکی در برابر تغییر یا تخریب ناخواسته محافظت کنید و مطمئن شوید که نسخه های پشتیبان دارید.
- خط مشی کیفیت خود را به گونه ای بنویسید که از دیده شدن آن توسط همه و همه خوشحال شوید. احتمالاً نسخه ای از آن در مراحل مناقصه رسمی درخواست می شود.
- مستندات فرآیند نباید همه نوشته شوند. میتوانید از تصاویر، ویدئوها، مدل ها و نمونه های اولیه برای زنده کردن آنها استفاده کنید، اما مطمئن شوید که تمام اطلاعات مرتبط را در آن گنجانده باشید. معنی دار کردن و در دسترس قرار دادن آنها برای همه کارمندان، تعامل و پایبندی به فرآیندهای برنامه ریزی شده را افزایش می دهد.
- فعالیت های نظارت و اندازه گیری خود را به طور منظم مرور کنید تا مطمئن شوید که موارد درست را نظارت و اندازه گیری می کنید. این فعالیت ها باید هوش تجاری مفیدی را در اختیار شما قرار دهند که میتواند نحوه عملکرد شما را مشخص کند.
- هیچ جایگزینی برای تعهد مدیریت ارشد وجود ندارد. یک QMS موثر توسط بالاترین سطح رهبری ترویج، حمایت و درگیر می شود.
پرسش های متداول
مراحل اجرای پیاده سازی ایزو 13485 چیست؟
پیاده سازی ایزو 13485 بر سه مرحله شامل: تفکر یا حسابرسی مبتنی بر ریسک، حسابرسی مبتنی بر فرآیند و ارائه مستندات استاندارد ISO 13485:2016 بر مبنای بندهای استاندارد ISO 13485 می باشد.
استاندارد ایزو 13485 ویرایش 2016 چند بند دارد؟
استاندارد ISO 13485:2016 شامل هشت بند:
بند 1: محدوده
بند 2: مراجع هنجاری
بند 3: اصطلاحات و تعاریف
بند 4: سیستم مدیریت کیفیت
بند 5: مسئولیت مدیریت
بند 6: مدیریت منابع
بند 7: تحقق محصول، و
بند 8: اندازه گیری، تجزیه و تحلیل و بهبود






